Maladie sommeil
Maladie sommeil
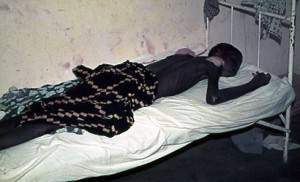
trypanosomiase africaine, communément appelée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire causée par un trypanosome (protozoaire flagellé), qui est transmis par la piqûre de la mouche tsé-tsé ou qui affecte les humains et les animaux.
La maladie est endémique dans certaines parties de l’Afrique subsaharienne, couvrant environ 36 pays et susceptibles de menacer 60 millions de personnes. Un 50 000 à 70 000 personnes sont actuellement infectées par an, le nombre a légèrement diminué ces dernières années.
Trois grandes épidémies ont eu lieu au cours des cent dernières années, l’une en 1896-1906 et deux en 1920 et 1970.
trypanosomiase animale est appelée Nagana («être déprimé» en zoulou).
Traitement
Histoire de traitement de la maladie du sommeil
En 1910, l’année de la découverte de Bruce, est l’introduction du premier médicament actif contre la maladie du sommeil, l’Salvarsan (arsphénamine), mis au point par Paul Ehrlich et Hata Sahachiro.However, l’utilisation de ce dérivé de l’arsenic présente des risques graves, y compris la cécité .Rattaché à une toxicité qui le rend peu maniable, l’efficacité de l’incitation à poursuivre les recherches Salvarsan vers des dérivés de l’arsenic, et d’autres molécules seront obtenus par dérivation de l’aminophénolarsinieux acide: l’tryparsamide et mélarsen, arsines acides, arsenic pentavalent de base; l’Arseno- phénylglycine, le melarsen-oxyde et le mélarsoprol, arsines oxydes d’acide, de base trivalent.
Mais il faut attendre jusqu’en 1919 pour le site final de l’œuvre de Walter Jacobs et Michael Heidelberger, qui permettra à Wade Brown et Louise Pearce a présenté le tryparsamide. Par conséquent, trois trypanocides a émergé dans les années 1920, la suramine (non-arsenic), et le tryparsamide orsanine, sont utilisés dans les campagnes de dépistage à grande et de traitement de masse. La suramine (Bayer 205), synthétisée en 1917, mais dont la formule tenue secrète, est élucidée par Ernest Fourneau en 1924 à l’Institut Pasteur, a été introduit en 1920.It est utilisé dans la première étape de la maladie ou si la résistance Arseno. Son administration par voie intraveineuse et à forte dose limite son utilisation. Toutefois, en dépit de sa toxicité importante, il est encore en usage en 2001 dans la phase lymphatico. Le tryparsamide, provenant de Atoxyl, a été introduit en 1921 et commercialisé en 1930 sous le nom de Tryponarsil.C’est le premier médicament sur la phase active encéphalo-rachidien. Cependant, même avec la dose réduite de toxicité oculaire progressive affecte 2% des patients traités au cours de la campagne menée par John Laigret au Congo Brazzaville à la mi-1920, et 4,4% de ceux traités par Eugène Jamot au Cameroun en même temps. Et chez les patients administré à un stade avancé, le taux de létalité était de 6,6% iatrogène. Le sodium orsanine (Fourneau 270) est utilisé à partir de 1925 et pendant quinze ans, seuls les patients ‘en temps douteux, ou en combinaison avec les patients tryparsamide à la deuxième étape.
Depuis le début des années 1930, le Congo belge, les premiers cas apparaissent arséno résistance et, à partir de 1934, tryparsamide est associée avec d’autres molécules, y compris la suramine et de sodium orsanine.
Le orsanine est laissée à la découverte en 1939 de la pentamidine, une molécule très efficace dans la première phase de la maladie, communément utilisé en Afrique occidentale comme un agent prophylactique, et permet la diminution de 1950 à des taux d’infection important si l’on croit possible éradication de la maladie.La suramine à son tour, généralement associée à tryparsamide, reste la drogue la plus utilisée dans le traitement de la maladie du sommeil jusqu’à ce que la fin des années 1960, progressivement remplacées à partir de 1949 par le mélarsoprol, développé par Friedheim et a une faible toxicité de l’arsenic tous les employés jusqu’à présent.
Enfin éflornithine (DFMO ou difluorométhylornithine), selon le plus moderne, a été développé dans les années 1970 par Albert Sjoerdsmanot et a subi des essais cliniques dans les années 1980. La molécule a été autorisée par la US Food and Drug Administration en 1990, mais Aventis, la compagnie pharmaceutique responsable de sa fabrication, a cessé sa production en 1999. En 2001, toutefois, Aventis, en liaison avec Médecins Sans Frontières et l’Organisation mondiale de la Santé, a signé un accord à long terme pour la fabrication et la distribution du médicament. Son efficacité est démontrée, sa tolérance est meilleure que le mélarsoprol. Il ya, cependant, la rechute de ce traitement dans un peu moins de 10% des cas, mais souvent mortelle.
thérapie combinée peut réduire le risque de rechute, y compris l’éflornithine association – nifurtimox semble particulièrement prometteuse.
Mégazol ®, molécule biologiquement active avec l’activité trypanocide, il a été quelques années d’études scientifiques.En effet, cette molécule, active sous forme de comprimés (voie orale) peut éliminer 100% du parasite dans 2 jours (in vitro et in vivo chez le chimpanzé et le porc). Toutefois, cette molécule est soupçonnée de provoquer le cancer et son développement a été arrêté.
Perspectives et voies de recherche
génome du parasite a été décodé et plusieurs protéines ont été identifiées comme cibles potentielles pour un traitement médicamenteux. Le décodage de l’ADN a également permis de comprendre pourquoi la production d’un vaccin pour cette maladie a été si difficile. T. brucei a plus de 800 gènes qui produisent des protéines qu’il utilise pour éviter la détection par le système immunitaire. (Berriman, et al., 2005)
Une équipe internationale de chercheurs qui travaillent dans la République démocratique du Congo, le Soudan et l’Angola impliquant Immtech International et l’Université de Caroline du Nord à Chapel Hill ont terminé les essais cliniques en phase I et a commencé un essai de phase III en 2005 de tester l’efficacité du premier traitement par voie orale la maladie du sommeil, connu pour l’instant que le ‘DB289’.
Des résultats récents indiquent que le parasite ne peut pas survivre dans le sang sans le flagelle. Cette découverte donne aux chercheurs un nouvel angle d’attaque pour éliminer le parasite.
Les chercheurs ont découvert un mécanisme de défense qu’ils peuvent utiliser pour créer de nouveaux traitements. Une protéine (la protéine haptoglobinrelated) découvert en 2006 et liée à des lipides dans le sang peut capturer l’hémoglobine et transportés à la graisse dont ils sont liés, qui contient une toxine mortelle pour le trypanosome Hpr. Ce mécanisme pourrait être une solution en utilisant la dépendance des trypanosomes immunitaire hemoglobin.When celui-ci a déjà été capturé par une protéine Hpr, les trypanosomes se lient également à la particule si grosse que les fléaux du parasite.
Le diagnostic de laboratoire
Le diagnostic repose sur la détection des trypanosomes par l’examen microscopique du liquide à partir d’un chancre de l’aspiration de la lymphe, sang, moelle osseuse, ou, dans les dernières étapes de l’infection, liquide céphalo-rachidien prélevé par ponction lombaire. trypanosomes mobiles sont recherchés sur une préparation humide et une préparation est également fixées et colorées par la méthode de Giemsa. Les techniques de concentration peuvent être utilisés avant l’examen microscopique. Pour les échantillons de sang, en utilisant la centrifugation, pour d’autres échantillons tels que le liquide céphalo-rachidien, des techniques de concentration incluent centrifugation suivie d’un examen du sédiment. L’isolement du parasite par inoculation chez le rat ou la souris est une méthode sensible, mais son utilisation est limitée à Tb rhodesiense.La détection d’anticorps a une sensibilité et une spécificité qui sont trop variables pour tirer des conclusions cliniques. En outre, l’infection par T. b. rhodesiense, la séroconversion se produit après l’apparition des symptômes cliniques et est donc d’une utilité limitée.
Trois tests sérologiques sont disponibles, comme pour la détection du parasite Gambie: le micro-CATT, wb-CATT sur, et wb-LATEX. Le premier utilise le sang coagulé, tandis que d’autres utilisent des échantillons de sang total. Ces tests consistent à faire réagir une goutte de sang sur un réactif sur la carte. Ils sont simples à mettre en œuvre et fournir un moyen de dépistage efficace. La sérologie est, par contre, quelques formes utiles Rhodésie, le diagnostic parasitologique priorité doit être donnée et est plus facile, car une plus grande concentration de parasites.
En neurologique, la ponction lombaire montre, en plus des parasites, l’augmentation de la teneur en protéines et la présence de globules blancs.
du cycle de vie
La mouche tsé-tsé est grand, brun et mordre furtive.The se sent comme une aiguille chaude coincé dans la chair. Au cours d’un repas de sang sur le mammifère hôte, une mouche tsé-tsé infectée (du genre Glossina) injecte dans le tissu trypomastigotes métacycliques peau. Les parasites pénètrent dans le système lymphatique et passent dans le sang (1).A l’intérieur de l’hôte, ils se transforment en trypomastigotes circulants dans le sang (2) et sont transportés vers d’autres endroits dans tout le corps, atteindre d’autres liquides organiques (par exemple, la lymphe, liquide céphalo-rachidien), et de continuer à reproduire par scissiparité (3). Le cycle parasitaire des trypanosomes africains est représentée par étapes extracellulaire. Une mouche tsé-tsé s’infecte avec trypomastigotes circulants en prenant un repas de sang sur un hôte infecté mammifères (4) (5). (Dans l’intestin de la mouche, les parasites se transforment en trypomastigotes procycliques, se multiplient par scissiparité (6), laisser l’intestin, et se transforment en épimastigotes (7). Les épimastigotes atteignent les glandes salivaires de la mouche et continuent leur multiplication par fission (8 ). Le cycle de la mouche dure environ 3 semaines.
Caractéristiques cliniques
Les symptômes commencent avec de la fièvre, des maux de tête typiquement intermittents et des douleurs articulaires. Un chancre (gonflement au site d’inoculation) est vu dans un sur cinq dans la forme mais Rhodesian est exceptionnel dans la forme gambienne. Comme les parasites pénètrent dans l’organisme par le sang et le système lymphatique, les ganglions lymphatiques gonflent souvent et atteignent des tailles énormes. signe de Winterbottom, postérieure des ganglions cervicaux (derrière le cou) peut apparaître.Sans traitement, la maladie s’étend progressivement les défenses de la personne infectée, et de nouveaux symptômes, y compris l’anémie, des troubles endocriniens, cardiaques et rénaux. La maladie entre alors dans une phase de troubles neurologiques quand le parasite franchit la barrière hémato-encéphalique. Les symptômes de cette deuxième phase de la maladie donne son nom; en plus de la confusion mentale et perte de coordination, le cycle du sommeil est perturbé, provoquant des accès de fatigue alternant avec des périodes d’agitation maniaque apparaissant avec le jour et la somnolence pendant la nuit d’insomnie. Sans traitement, la maladie est mortelle, avec une détérioration mentale progressive conduisant au coma et la mort. Les dégâts causés dans la phase neurologique peuvent être irréversibles.
La durée de la maladie varie selon le parasite en cause. L’évolution est plus rapide dans le cas de trypanosomiase rhodesiense (quelques semaines à plusieurs mois). Il peut être de plusieurs années dans le cas de trypanosomiase gambiense.
L’atteinte cardiaque peut être vu dans la forme gambienne, principalement sur le type d’électrocardiogramme anormal sans conséquence. Cette réalisation reste en arrière-plan, contrairement à la forme américaine de la trypanosomiase (maladie de Chagas).
Prévention et contrôle
accent sur la prévention et de contrôle, si possible, sur la disparition de l’hôte-parasite, la mouche tsé-tsé ont été fly.Two stratégies utilisées en alternance dans les tentatives pour réduire la trypanosomiase africaine. Une tactique est essentiellement médical ou d’une maladie vétérinaire est directement en utilisant la prophylaxie, le traitement et la surveillance afin de réduire le nombre de porteurs de maladies organismes. La deuxième stratégie est généralement entomologiques et a l’intention de perturber le cycle de transmission en réduisant le nombre de mouches.
‘